
新闻资讯
关于结晶样视网膜变性
结晶样视网膜变性(Bietti crystalline dystrophy,BCD)又称Bietti结晶样视网膜病变,是一种常染色体隐性遗传的进展性视网膜变性疾病。BCD致病基因是位于4q35的CYP4V2,编码一种与脂肪代谢相关的蛋白酶。在世界范围内BCD均有分布,但在中国、日本和韩国人群中更为普遍。大多数BCD患者于20-40岁发病,出现夜盲和视力下降等症状,在50-60岁发展为法定盲人。基于临床特征和基因检测鉴定CYP4V2中的双等位基因致病变异,BCD可被确诊,然而仍缺乏有效的临床治疗手段。
关于VGR-R01
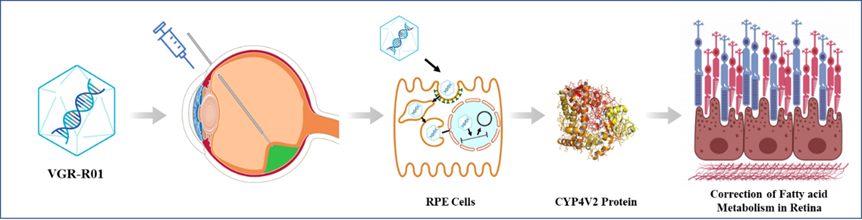
VGR-R01是针对CYP4V2基因突变导致的BCD患者的基因治疗产品。CYP4V2蛋白为P450酶家族成员,在视网膜色素上皮细胞(RPE)中高度表达,具有脂肪酸羟化酶活性,与脂肪代谢相关。VGR-R01的作用原理是一种基因替代疗法。
VGR-R01通过视网膜下腔注射给药后,AAV衣壳蛋白介导RPE细胞的转导,将VGR-R01基因表达盒递送至细胞核。VGR-R01表达盒以游离DNA的形式存在,在RPE细胞表达CYP4V2蛋白,以重建细胞的脂肪酸羟化酶活性。VGR-R01通过纠正患者视网膜内的脂肪酸代谢障碍,以期达到预防或改善RPE细胞、感光细胞及脉络膜的结构和/或功能损伤,并实现纠正视力损伤、保护残存视功能、或延缓视力恶化的临床效果。
VGR-R01的早期临床研究
首都医科大学附属北京同仁医院正在开展“VGR-R01治疗结晶样视网膜色素变性(BCD)的早期临床研究”(NCT05399069),目前已完成部分受试者给药,初步结果提示VGR-R01的安全性良好,且具有改善视功能的趋势。